Методы секвенированияУчебные материалы по биологии / Генная инженерия / Методы секвенированияСтраница 1
Генетическая инженерия как отрасль биотехнологии во многом обязана своим успешным развитием появлению относительно простых методов, позволяющих достаточно быстро определить последовательность нуклеотидов в исследуемых фрагментах ДНК.
Дидезоксинуклеотидный метод секвенирования ДНК. Дидезоксинуклеотид - это полученный искусственным путем нуклеотид, лишенный 2'- и 3'-гидроксильных групп при углеродных атомах сахарного кольца (рис. 5, А). У дезоксинуклеотида, входящего в норме в состав ДНК, отсутствует только 2'-гидроксильная группа (рис. 5, Б).
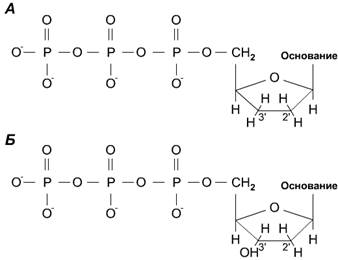
Рис. 5. Отличие дидезоксинуклеотида от дезоксинуклеотида
А - дидезоксинуклеотид: отсутствуют 2' и 3'-гидроксильные группы в дезоксирибозном кольце; Б - дезоксинуклеотид: отсутствует только 2'-гидроксильная группа.
Удлинение цепи во время репликации ДНК происходит в результате присоединения очередного нуклеозидтрифосфата к 3'-гидроксильной группе последнего нуклеотида растущей цепи. И если таким очередным присоединяемым звеном является дидезоксинуклеотид, то синтез ДНК останавливается, поскольку следующий нуклеотид не может образовать фосфодиэфирную связь. Остановка синтеза ДНК - это ключевой этап дидезокси-метода, но чтобы осуществить секвенирование в полном объеме, необходимо выполнить целый ряд условий.
Первый шаг стандартной процедуры дидезокси-секвенирования состоит в гибридизации синтетического олигонуклеотида длиной 17-20 звеньев со специфическим участком одной из цепей клонирующего вектора, соседствующим со вставкой. Этот олигонуклеотид является праймером, поставляющим 3'-гидроксильную группу для инициации синтеза. Раствор с праймером распределяют по четырем пробиркам, в каждой из которых находятся четыре дезокси-нуклеотида, dATP, dСТР, dGТР и dTТР (один из них - изотопно меченный), и один из четырех дидезоксинуклеотидов (ddАТР, ddСТР, ddGТР или ddTТР). Концентрацию каждого дидезоксинуклеотида подбирают таким образом, чтобы он оказался включенным по всем позициям в смеси растущих цепей, а не только в первой встретившейся ему позиции. По окончании ферментативного синтеза при участии ДНК-полимеразы в каждой пробирке оказывается уникальный набор олигонуклеотидов, каждый из которых содержит праймерную последовательность.
Далее в пробирки добавляют формамид, чтобы обеспечить расхождение цепей, и проводят электрофорез в полиакриламидном геле на четырех дорожках (по числу пробирок). Это позволяет разделить одноцепочечные фрагменты ДНК, даже если они различаются по длине всего на один нуклеотид. На радиоавтографе обнаруживается набор полос, отвечающих меченым фрагментам ДНК, сопоставление которых позволяет прямо «прочитать» нуклеотидную последовательность секвенируемого сегмента ДНК.
Секвенирование ДНК с помощью вектора на основе фага М13. Метод основывается на применении фага М13 E. coli в качестве вектора. ДНК этого фага представляет собой одноцепочечную кольцевую молекулу. Когда им инфицируют E. coli, сначала образуется двухцепочечная репликативная форма фаговой ДНК, а одноцепочечные кольцевые молекулы, которые затем упаковываются в вирионы, синтезируются на этой двухцепочечной молекуле как на матрице. Клетки, инфицированные М13, не подвергаются лизису; в них непрерывно образуются новые одноцепочечные молекулы ДНК М13, которые, проходя через клеточную мембрану, одеваются белковой оболочкой и выходят в окружающую среду. ДНК М13 содержит несущественную часть, которую можно заменить нужным фрагментом ДНК; при этом инфекционность рекомбинантных вирусных частиц сохранится.
М13-система имеет следующие преимущества: выделенная двухцепочечная репликативная форма может функционировать как плазмида, а одноцепочечная фаговая ДНК - использоваться в качестве матрицы для секвенирования ДНК. Все это позволяет использовать фаг М13 как комбинированную систему для клонирования и секвенирования ДНК.
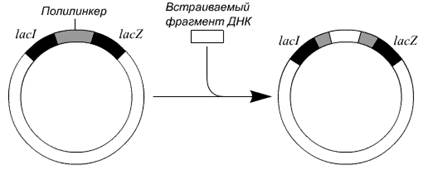
Принцип метода. Обычно нужный фрагмент ДНК длиной примерно 500 п. н. встраивают в полилинкер, который является частью клонированного в РФ-ДНК фага М13 модифицированного гена lacZ' (рис. 6). Рекомбинантной вирусной ДНК трансформируют компетентные клетки E. coli и высевают их на чашки со средой, содержащей субстрат X-Gal. При его гидролизе β-галактозидазой образуется продукт, имеющий синюю окраску. На чашках появляются белые (бесцветные) и синие колонии. Первые отвечают клеткам, инфицированным фагом М13 со вставкой, нарушившей рамку считывания гена lacZ', вторые - клеткам, инфицированным фагом М13 с функциональным геном lacZ', не несущим вставки. Из белых колоний выделяют фаговые частицы, а из них - одноцепочечную ДНК со вставкой. Для секвенирования последней отжигают выделенную ДНК с праймером, который гибридизуется с последовательностью вблизи вставки, затем проводят дидезокси-секвенирование, электрофорез и радиоавтографию и «прочитывают» нуклеотидную последовательность вставки.